Improving Lives - Career in Health and Exercise Science
Table des matières:
- Qu'est-ce qu'une boucle fermée hybride?
- Minimed 670G Caractéristiques du produit
- Disponibilité et coût
- La FRDJ a publié un communiqué de presse mercredi, exprimant son enthousiasme pour cette technologie de pointe et la rapidité avec laquelle la FDA a déménagé. L'American Diabetes Association a également émis un communiqué de presse sur cette approbation, notant sa signification.
- Il convient de noter que la FDA a également donné son feu vert au système Abbott Freestyle Libre Pro ici aux États-Unis
- Ce contenu est créé pour Diabetes Mine, un blogue sur la santé des consommateurs axé sur la communauté du diabète. Le contenu n'est pas examiné médicalement et ne respecte pas les lignes directrices éditoriales de Healthline. Pour plus d'informations sur le partenariat de Healthline avec Diabetes Mine, veuillez cliquer ici.
Wow, quel grand moment pour la communauté du diabète!
Mercredi, la FDA a approuvé le Minimed 670G de Medtronic, le tout premier système hybride à boucle fermée capable de surveiller automatiquement le glucose et d'ajuster les doses d'insuline basale chez les personnes de 14 ans et plus atteintes de diabète de type 1.

Alors que nous, membres de la communauté du diabète, réalisons que ce n'est pas un PA complètement fermé qui prend complètement le contrôle du diabète, et Medtronic lui-même prend soin de le qualifier d '«hybride», le nouveau Minimed 670G représente un énorme pas en avant dans l'automatisation de notre gestion de la maladie. Woot!
Voici la lettre officielle de la FDA à Medtronic concernant cette autorisation, ainsi que le communiqué de presse de la FDA.
Remarquablement, cette approbation réglementaire ne vient que 104 jours (!) Après que Medtronic a soumis des milliers de pages de documents, soit sept mois plus tôt que prévu et cette approbation couvre plus d'une décennie de recherche, de politique, et le développement de produits pour atteindre ce jalon.
"C'est phénoménal, et je suis tellement excité! »Dit Aaron Kowalski, chef de mission de la FRDJ et de longue date de type 1 lui-même. "C'est incroyable d'être à ce niveau. Pensez-y - c'est la première fois que l'un d'entre eux (systèmes automatisés) a été approuvé … et le peu de temps qu'il a fallu à la FDA pour effacer cela. "
Donc,
Qu'est-ce qu'une boucle fermée hybride?
Dans ce cas, le terme «hybride» signifie que le système est partiellement automatisé, mais qu'il nécessite un certain contrôle de la part de l'utilisateur.
Le capteur CGM lit les données de glucose toutes les cinq minutes, et l'algorithme de boucle fermée intégré à la pompe utilise cette information pour augmenter ou diminuer l'insuline basale afin de maintenir des niveaux de glucose aussi proches que possible de la cible. mg / dL Les utilisateurs doivent toujours entrer le nombre de glucides et le bolus pour les repas, alerter le système avant tout exercice, ne pas donner de bolus de correction automatique basé sur le CGM, mais suggérer des montants de correction lorsque le résultat est est entré exactement comme toutes les pompes à insuline standard via la fonction Assistant bolus.
< ! --1 ->Cette page FDA fait un bon travail expliquant les détails. Le système MiniMed 670G possède deux modes, un de plus que l'autre "pilote automatique", mais nécessitant une intervention de l'utilisateur (donc pas une boucle complètement fermée):
Mode manuel - dans lequel le système peut être programmé l'utilisateur à administrer de l'insuline basale à un débit constant préprogrammé.Le système interrompt automatiquement la distribution d'insuline si la valeur de glucose du capteur tombe au-dessous ou est prévue pour tomber au-dessous d'un seuil prédéterminé. Le système reprendra aussi automatiquement l'administration de l'insuline une fois que les valeurs de glucose du capteur auront dépassé ou seront supérieures à un seuil prédéterminé.
Mode automatique - le système peut ajuster automatiquement l'insuline basale en augmentant, en diminuant ou en suspendant continuellement l'administration d'insuline en fonction des valeurs de CGM (différent du mode manuel où l'insuline basale est délivrée taux). Bien que le mode automatique puisse automatiquement ajuster l'administration d'insuline basale sans l'intervention de l'utilisateur, l'utilisateur doit toujours administrer l'insuline manuellement pendant les repas.
Il s'agit d'un nouveau type de dispositif jamais vu sur le marché - et le fait qu'il ait été homologué ici aux États-Unis avant de pénétrer les marchés européens et internationaux, peut difficilement être surestimé.
Minimed 670G Caractéristiques du produit
Extérieurement, le Minimed 670G ressemble et se sent presque identique au Minimed 630G récemment approuvé par l'entreprise qui apporte une nouvelle orientation verticale et un écran couleur à la conception de pompe standard de Medtronic.

La grande différence est que ce combo pompe à insuline-CGM est contrôlé par un algorithme sophistiqué. Medtronic nomme sa technologie «SmartGuard Hybrid Closed Loop», qui permet d'ajuster automatiquement l'insuline basale et l'arrêt automatique en cas de besoin. Les caractéristiques du produit sont les suivantes:
- Unité de pompage: Comme indiqué, le look est le même que le Minimed 630G introduit le mois dernier (déjà obsolète?). La même pile AA, les mêmes ensembles de perfusion et un réservoir d'insuline de 300 unités, et un peu plus grand que les pompes Minimed de style traditionnel avec leur orientation horizontale. Contrairement aux anciennes pompes Medtronic, cet appareil est uniquement offert en noir, mais vous pouvez acheter un certain nombre de peaux différentes pour égayer le look si vous le souhaitez.
- Boutons et menus: Les seules différences légères entre le 630G et le nouveau MiniMed 670G sont le fait que le bouton en haut à droite vous amène directement aux graphiques CGM, par rapport au chemin des menus, et le menu lui-même diffère un peu , étant donné les nouveaux choix de mode, etc., sur le nouveau système.
- Ecran couleur: Tout comme le 630G, le nouveau système arbore également un écran couleur brillant (!) Qui s'adapte automatiquement aux situations d'éclairage. Par exemple, la nuit, il ne s'allume pas aussi brillamment que possible. au cours de la journée. Cela semble être beaucoup plus facile à lire, un grand avantage pour toute personne ayant une déficience visuelle, bien sûr. Outre les données de base de la pompe et de la CGM, Insulin on Board (IOB) s'affiche directement sur l'écran d'accueil, ce que les utilisateurs réclament.
- CGM Tech: Le nouveau système utilise le capteur CGM de quatrième génération en forme de coquillage de Medtronic, connu sous le nom d'Enlite 3, mais qui sera maintenant connu sous le nom de capteur Guardian 3 ( ). tous les différents termes de Medtronic sur Storify ). Il est autorisé par la FDA à porter sur le corps pendant 7 jours, par rapport à 6 jours pour les générations précédentes.Rien n'est nouveau sur le front adhésif, cependant.

- Précision améliorée: Le Guardian 3 est plus fiable et précis, dit Medtronic, car il utilise un nouveau signal radio (introduit avec le 630G) pour communiquer entre l'émetteur et le capteur. Selon les données de l'essai clinique pivot de l'entreprise à deux étalonnages par jour, le taux d'erreur MARD est en moyenne de 10,55%, ce qui n'est pas aussi bon que le dernier Dexcom G5 à 9% mais est bien meilleur que le ~ 14% Enlite a à offrir - c'est donc un changeur potentiel pour faire de Medtronic un concurrent plus fort sur le marché du CGM!
- Votre mode peut varier: Medtronic dit qu'il a écouté les gens pour leur demander de choisir entre les modes: Mode automatique pour la fonction de boucle fermée hybride, ou Mode manuel qui offre toujours la fonction de suspension pour lorsque vous franchissez ce seuil hypo (comme les 530G et 630G ont tous deux), et le Suspend Before Before qui peut être configuré pour prédire les hypos 30 minutes avant qu'ils ne surviennent (comme dans le 640G internationalement disponible).

- Définir la cible BG: Cette technologie est conçue pour «traiter pour cibler», ce qui signifie que les niveaux de glycémie doivent rester proches de 120 mg / dL. Malheureusement, cela ne peut pas être changé … ce qui signifie que Medtronic prend seulement la "personnalisation et la personnalisation" jusqu'à présent. L'utilisateur peut définir une cible temporaire de 150 mg / dL jusqu'à 12 heures pour faire face à des situations comme l'exercice, mais c'est la seule flexibilité intégrée. Medtronic explique que cela a été le résultat d'une tentative de commercialisation. Cela signifie des essais cliniques beaucoup plus importants qui auraient retardé l'approbation réglementaire et la commercialisation. Les générations futures permettront probablement d'atteindre des niveaux cibles variables, selon Medtronic.
- Pas de partage de données: Comme le précédent système Minimed 630G, cette boucle fermée hybride 670G ne possède pas de Bluetooth intégré et ne fonctionnera pas avec Minimed Connect pour le partage de données sur téléphone mobile ( ?!). Pour ceux qui veulent un partage de données, Medtronic pointe les gens vers leur système Minimed 530G qui a maintenant plus de trois ans. En raison de ce manque de connectivité, le 670G ne fonctionnera avec aucune des applications mobiles IBM Watson ou de partage de données en cours de développement.
- Compteur BG connecté: Le système est configuré pour communiquer directement avec le Bayer Contour Link 2. 4 Mètres qu'Ascensia a introduit avec l'annonce de lancement 630G. Ceci permet un bolus distant à partir du compteur, mais seulement en mode manuel plutôt qu'en mode automatique en boucle fermée.
- Deux étalonnages quotidiens: Le système nécessite au moins une calibration au bout des doigts toutes les 12 heures et, si elle n'est pas saisie, l'utilisateur passe automatiquement en mode automatique.
- Serter One-Press: Le 670G utilise le nouveau Serter One-Press de Medtronic qui, selon lui, facilitera l'REPLACEion du capteur et le rendra plus confortable. Il suffit d'appuyer une seule fois sur le bouton, comparé à l'ancien modèle plus encombrant et nécessitant deux pressions sur les boutons (une fois pour insérer et une fois pour se rétracter).
- Enfants et adolescents: Minimed 670G est officiellement labellisé pour les 14 ans et plus, mais la compagnie affirme qu'elle effectue déjà des essais pour les enfants de 7 à 13 ans, ainsi que des études de faisabilité pour des enfants de 2 ans. L'actuelle lettre d'approbation de la FDA stipule spécifiquement que le 670G ne doit pas être utilisé chez les moins de 7 ans, ni chez ceux qui prennent moins de 8 unités d'insuline par jour (car l'appareil nécessite ce minimum par jour pour fonctionner en toute sécurité). Metronic dit qu'il ne dispose pas de suffisamment de données chez ceux qui prennent moins de 8 unités par jour pour savoir si l'algorithme est efficace et sûr.
Disponibilité et coût
Avec l'approbation réglementaire beaucoup plus rapide que prévu, Medtronic nous dit qu'ils ont besoin d'au moins six mois pour préparer le lancement du produit américain à partir du printemps 2017. Pour ceux qui sont hors des États-Unis, Medtronic s'attendre à une approbation réglementaire vers la mi-2017.
Il y a beaucoup de "pièces mobiles" qui doivent être en place avant le lancement ici en Amérique, expliquent-ils, et elles sont actuellement en cours au milieu du lancement du Minimed 630G; ce modèle précédent a récemment commencé à être expédié aux patients aux États-Unis
Oui, il y aura une voie de mise à niveau pour quiconque utilise les produits actuels de Medtronic - appelée Programme d'accès prioritaire. Il encourage les clients à commencer avec la Minimed 630G dans les mois à venir avant que la 670G arrive sur le marché, annonçant qu'une transition comme celle-ci aidera les patients à s'entraîner pour la nouvelle plate-forme et à réduire leurs frais à 0 $.
- Coût initial du programme Accès prioritaire = 799 $
- Crédit de reprise sur la pompe MiniMed 630G et SGC = 500 $
- Coût total du programme = seulement 299 $
- Participer aux sondages et aux autres programmes de rétroaction des utilisateurs Le programme d'accès prioritaire est en vigueur jusqu'au 28 avril 2017. Medtronic indique également que d'autres offres et possibilités de mise à niveau pourraient être révélées plus proches du lancement au printemps.
Naturellement, Medtronic travaillera également dans les prochains mois avec les payeurs et les compagnies d'assurance sur la couverture de cette technologie. Avec toute la controverse récente sur ces questions (#DiabetesAccessMatters), nous espérons que Medtronic gardera à l'esprit que bien que de nombreux patients voudront ce système, ce n'est peut-être pas le meilleur choix pour tous - et les questions de choix!
«Un moment décisif … Transformer les soins du diabète»
La FRDJ a publié un communiqué de presse mercredi, exprimant son enthousiasme pour cette technologie de pointe et la rapidité avec laquelle la FDA a déménagé. L'American Diabetes Association a également émis un communiqué de presse sur cette approbation, notant sa signification.
Pensez-y: il y a dix ans, beaucoup pensaient encore qu'un système en boucle fermée de toute sorte était un pipedream. Mais la FRDJ a établi un véritable plan d'action en vue de l'adoption d'un pancréas artificiel. C'était encore les premiers jours de la technologie CGM … et regardez jusqu'où nous sommes arrivés!
"Cela a été incroyablement rapide, et cela montre à quel point tout le travail que nous avons accompli sur le plan politique était important pour créer des conseils pour ces systèmes", a déclaré Kowalski, qui a personnellement a joué un rôle important en faisant du développement de la technologie AP une priorité.«Cela a tout changé et a créé une voie, et maintenant nous sommes ici, c'est un moment décisif qui a le potentiel de transformer les soins du diabète!»En fait, la FDA a approuvé le marché pour cette Minimed 670G tout en exigeant des études post-commercialisation supplémentaires visant à mieux comprendre le fonctionnement de l'appareil dans des conditions réelles. Cela montre que la FDA est prête à regarder les données existantes et à faire confiance aux avantages, sans se retenir pour des tonnes de données futures.

Nous avons également discuté avec Jeffrey Brewer, qui dirige Bigfoot Biomedical, qui développe son propre système de boucle fermée qui devrait être disponible courant 2018. Avec Aaron Kowalski, Brewer est considéré comme l'un des «Pères de l'AP» compte tenu de leur rôle dans le développement et la promotion du cheminement en boucle fermée à la FRDJ.
Sans aucun doute, cela fera avancer l'aiguille sur les plus de 18 autres systèmes en boucle fermée en cours d'exécution - en particulier ceux qui utilisent l'insuline seulement. Certains ajoutent l'hormone glucagon supplémentaire au mélange pour lutter contre l'hypoglycémie (comme Beta Bionics iLET et Pancreum Genesis), ce qui peut nécessiter plus de temps d'évaluation de la FDA.
C'est formidable de voir la FDA évoluer aussi rapidement, non seulement sur cette approbation Minimed 670G, mais aussi sur d'autres développements technologiques et de données sur le diabète au cours des dernières années. De toute évidence, la FDA reconnaît le mouvement #WeAreNotWaiting, et fait de son mieux pour suivre ces temps rapides.
La FDA approuve Libre Pro
Il convient de noter que la FDA a également donné son feu vert au système Abbott Freestyle Libre Pro ici aux États-Unis
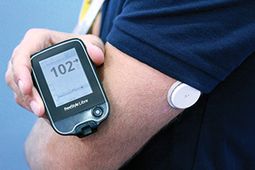
Aussi appelé système «hybride» - mais uniquement pour la surveillance de la glycémie - Abbott Libre se compose d'un petit capteur rond porté jusqu'à 14 jours à l'arrière du bras et d'un contrôleur que les utilisateurs balaient sur lui autant de fois par jour que nécessaire ou souhaité pour prendre des lectures de glucose sans fil.
Il n'offre aucune alarme pour l'augmentation ou la baisse des niveaux de glucose, et la version grand public à l'étranger ne stocke que 8 heures de données.Le but est de créer une solution de surveillance plus simple qui pourrait aussi aider beaucoup de type 2 à être plus en contact avec leurs niveaux de glucose en temps réel.
Bien qu'il ne s'agisse pas d'un CGM traditionnel tel que nous le connaissons, Abbott dit que les règles de régulation classent Libre en tant que CGM. Et ce qu'ils ont approuvé maintenant est une version conçue spécifiquement pour les médecins à prêter à leurs patients pour une utilisation à court terme, et il fournit seulement des données à l'insu pour les médecins à voir. C'est un premier pas vers la version grand public, qu'Abbott a récemment déposé pour l'approbation de la FDA ici aux États-Unis.
J'espère que ce sera bientôt le cas, avec la procédure accélérée d'innovation de la FDA.
Un grand merci à toutes les personnes impliquées - et en particulier à la FDA - pour avoir fait progresser ces importants outils de prise en charge du diabète dans tous nos intérêts!
Avis de non-responsabilité
: Contenu créé par l'équipe de la mine Diabetes. Pour plus de détails cliquer ici. Avis de non-responsabilitéCe contenu est créé pour Diabetes Mine, un blogue sur la santé des consommateurs axé sur la communauté du diabète. Le contenu n'est pas examiné médicalement et ne respecte pas les lignes directrices éditoriales de Healthline. Pour plus d'informations sur le partenariat de Healthline avec Diabetes Mine, veuillez cliquer ici.
Première pompe à insuline intégrée au monde avec moniteur continu Approuvé par la FDA

Essai - Test du système de boucle fermée Diabetes Medtronic 670G

Un homme du Minnesota est l'une des 15 personnes faisant partie d'une étude en cours sur le Minimed 670G, précurseur d'un système pancréatique artificiel.
Diabète Revue du produit: Boucle fermée hybride Medtronic 670G

Diaporamas de Medtronic Diabète: un système de première génération sur la nouvelle boucle hybride Minimed 670G de la technologie du pancréas artificiel.

