La dépression saisonnière : symptômes et solutions naturelles
Bonnes nouvelles, D-Friends: la nouvelle insuline inhalable à action rapide connue sous le nom d'Afrezza vient d'obtenir l'approbation de la FDA!
La troisième fois est le charme de cette nouvelle formulation d'insuline inhalable, la deuxième à avoir traversé le processus de réglementation des États-Unis après l'échec d'Exubera de Pfizer il y a une bonne partie d'une décennie.
Vendredi, la société de biotechnologie californienne MannKind Corp. a finalement obtenu l'autorisation réglementaire pour son dispositif Afrezza.

Maintenant, après la nouvelle soumission d'Afrezza en octobre 2013, MannKind a finalement convaincu la FDA qu'elle était prête à tomber entre les mains d'adultes atteints de diabète!
Les dirigeants de MannKind nous disent qu'ils travaillent pour trouver un partenaire pharmaceutique pour fabriquer et distribuer Afrezza, et que le produit pourrait être disponible dès janvier ou fin du premier trimestre de 2015. > Dans son communiqué publié vendredi, le Dr Jean-Marc Guettier, de la Division des produits du métabolisme et de l'endocrinologie de l'agence, déclare: «L'approbation d'aujourd'hui élargit les options disponibles pour l'administration d'insuline au moment du repas. pour contrôler les niveaux de sucre dans le sang. "
Afrezza est une insuline ultrarapide sous forme de poudre qui est conçue comme une insuline avant le repas pour les adultes (pas encore pour les enfants ) avec un diabète de type 1 ou de type 2. Il vise les pics de glycémie après le repas, c'est-à-dire utilisés avec un traitement à l'insuline existant et non destinés à être un traitement autonome à l'insuline.
L'insuline en poudre est administrée à l'aide d'un inhalateur à sifflet appelé Dreamboat, qui a été développé après le premier cycle FDA et a causé des retards parce que l'agence voulait plus d'études cliniques utilisant ce nouvel inhalateur. La poudre se dissout immédiatement lorsqu'elle est inhalée dans les poumons et l'insuline est ensuite rapidement déversée dans la circulation sanguine pour commencer à travailler. Afrezza culmine en 12 à 15 minutes et est hors du système en moins d'une heure, comparé aux insulines à court terme qui prennent habituellement au moins 20 minutes pour se déclencher, culminent à 2-3 heures, et peuvent rester dans le système pendant jusqu'à cinq heures.
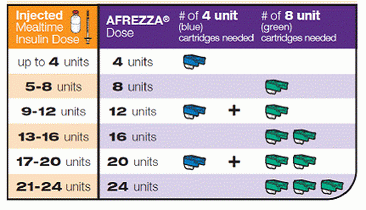
Bien sûr, le plus grand attrait est qu'il ne nécessite aucune aiguille, mais seulement un petit inhalateur portable qui ressemble vraiment à un sifflet.Le Dreamboat est destiné à être jeté après 15 jours pour éviter toute accumulation de poudre à l'intérieur qui pourrait obstruer l'appareil. Contrairement à l'insuline traditionnelle, elle ne nécessite aucune réfrigération, mais est conservée à température ambiante. Chaque cartouche à usage unique contiendrait 4 ou 8 unités, et au moment où Afrezza est commercialisée, il pourrait y avoir une cartouche de 12 unités disponibles.
Voici comment vous pourriez en doser, en convertissant l'injection d'insuline actuelle ou les quantités de bolus en une dose inhalable d'Afrezza:
Personnellement, cela ne semble pas être beaucoup d'insuline pour couvrir certains des repas que je mange. il faut des doses plus élevées … Je passerais par tout un tas de ces petites cartouches. Donc, pour certaines personnes handicapées, cet appareil peut présenter un défi logistique en termes de dosage facile des quantités dont nous avons besoin …? Mais encore une fois, cela peut être un bon outil pour abattre les sucres élevés du sang avec correction dosage.
Lors d'une conversation téléphonique vendredi soir, le président de MannKind, Hakan Edstrom, nous a dit que la société n'avait pas encore conclu d'accords avec des partenaires potentiels pour fabriquer et distribuer Afrezza. Mais il se rapproche, et en discussions avec un certain nombre d'entreprises pour finaliser un partenariat dès que possible.
Les coûts restent à déterminer (beaucoup dépend du partenariat potentiel), mais Edstrom dit qu'ils s'attendent à ce que les prix se situent dans la même fourchette que ce que les patients américains paient pour les stylos à insuline aux États-Unis
Cette approbation est un développement énorme, et cela fait longtemps que huit ans se sont écoulés depuis que cette quête a été lancée par Alfred Mann - l'homme qui a fondé Minimed avant d'être racheté par Medtronic. Nous suivons l'histoire d'Afrezza depuis des années ici à la <Mine
- depuis les premiers jours de dépôt de la FDA, quand MannKind a eu son design clunkier initial, jusqu'à la couverture plus récente de l'utilisation d'Afrezza dans le pancréas artificiel essais cliniques.
Le comité consultatif qui s'est réuni le 1er avril de cette année a voté 13 contre 1 qu'Afrezza était suffisamment sûre et efficace pour être approuvée en tant que traitement pour le diabète de type 1, le dissident solitaire David Cooke votant que les risques dépassaient 1s.Il a souligné l'examen interne de la FDA qui a montré que certains patients prenant Afrezza ont arrêté le traitement après avoir développé des spasmes bronchiques, de la toux et une baisse du fonctionnement de leurs poumons. Mais aucune de ces préoccupations n'a été soulevée lors du vote sur Afrezza pour l'utilisation de type 2, et la commission a décidé à l'unanimité en faveur d'un vote 14-0.
En approuvant Afrezza, la FDA a joint un certain nombre de stipulations sur la sécurité, l'efficacité et l'usage des patients:Il est déconseillé aux personnes diabétiques qui fument, ni au traitement de l'acidocétose diabétique (ACD).

La FDA exige une mise en garde encadrée, indiquant que certaines personnes atteintes d'asthme et de bronchopneumopathie chronique obstructive (BPCO) ayant utilisé Afrezza ont souffert d'un bronchospasme aigu. Par conséquent, les personnes atteintes d'une maladie pulmonaire chronique, d'asthme ou de MPOC ne devraient pas utiliser Afrezza en raison de ce risque. Les réactions défavorables les plus communes associées à Afrezza dans les essais cliniques étaient l'hypoglycémie, la toux, et la douleur ou l'irritation de gorge.
Une partie des exigences d'approbation est une stratégie d'évaluation et d'atténuation des risques, qui doit inclure un plan de communication pour informer les professionnels de la santé du risque grave de bronchospasme aigu associé à Afrezza. Cela signifie que les avantages l'emportent sur les risques potentiels liés à l'utilisation d'Afrezza.
- D'autres études post-commercialisation sont nécessaires sur Afrezza, telles que: essai clinique pour évaluer le risque potentiel de malignité pulmonaire à l'utilisation (cet essai évaluera également le risque cardiovasculaire et l'effet à long terme d'Afrezza sur la fonction pulmonaire); et deux essais cliniques pharmacocinétiques-pharmacodynamiques euglycémiques de clampage du glucose, l'un pour caractériser la dose-réponse et l'autre pour caractériser la variabilité intra-sujet.
- Edstrom nous a dit qu'ils prévoyaient de commencer les essais pédiatriques le plus tôt possible, ce qui devrait commencer de façon réaliste vers la mi-2015. Cela signifie qu'Afrezza pourrait ne pas être approuvé pour les enfants atteints de diabète jusqu'en 2017, et que le processus de réglementation peut varier en fonction des études post-commercialisation et de l'expérience des adultes.
- Et malgré le feu vert de la FDA, il n'y a aucune garantie Afrezza connaîtra un succès commercial ou que les personnes handicapées vont affluer pour l'utiliser. Comme indiqué, MannKind n'a pas encore obtenu de partenaires pharmaceutiques prêts à vendre Afrezza. Mais si les gains de MannKind en mai est une indication de ce qui arrive bientôt, un partenariat potentiel n'est peut-être pas loin.
- Du point de vue des investisseurs, beaucoup sont sceptiques à cause de l'insuline inhalée d'Exubera, qui a échoué dans la discussion sur Afrezza au cours des dernières années. Ce produit commun de Pfizer-Sanofi a été retiré du marché en 2007 après plus d'une année de sous-ventes, ce qui a permis d'atteindre un chiffre record de 2 $. 8 milliards de perte pour les vendeurs.
- Naturellement, MannKind affirme qu'Afrezza est significativement différente, principalement parce qu'Exubera a utilisé un inhalateur à pied long et était lié à un risque plus élevé de cancer du poumon que Pfizer ne pouvait tout simplement pas surmonter.
Nous verrons ce que la communauté D pense maintenant avec Afrezza, en particulier avec toute l'attention portée aux essais cliniques de l'AP plus récemment. Que ce soit suffisant pour convaincre les masses n'est pas encore clair …
Inspirez les nouvelles pour l'instant, et nous verrons combien de temps il nous faut pour expirer et transformer cette excitation en ventes effectives et en utilisation généralisée.
Avis de non-responsabilité
: Contenu créé par l'équipe de la mine Diabetes. Pour plus de détails cliquer ici.
Avis de non-responsabilité
Ce contenu est créé pour Diabetes Mine, un blogue sur la santé des consommateurs axé sur la communauté du diabète. Le contenu n'est pas examiné médicalement et ne respecte pas les lignes directrices éditoriales de Healthline. Pour plus d'informations sur le partenariat de Healthline avec Diabetes Mine, veuillez cliquer ici.
Diabète Nouvelles: Dexcom SHARE obtient l'approbation de la FDA!

Le système sans fil Bluetooth Dexcom SHARE a reçu le feu vert de la FDA. Dexcom SHARE permet d'envoyer les données de votre CGM à votre smartphone.
Inhalé L'insuline Afrezza a reçu l'approbation de la FDA

. La FDA a approuvé un nouveau produit à base d'insuline par inhalation. Afrezza est une insuline ultrapapide sous forme de poudre, conçue comme pré-repas pour les diabétiques de type 1.
Afrezza, afrezza 4 unité (30) - 8 unité (60), afrezza 4 unité (60) - 8 unité (30) (insuline (inhalation)) effets secondaires, interactions, utilisations et empreinte médicamenteuse

Information sur les médicaments pour Afrezza, Afrezza 4 unité (30) - 8 unité (60), Afrezza 4 unité (60) - 8 unité (30) (insuline (inhalation)) comprend les images, les effets indésirables, les interactions médicamenteuses, le mode d'emploi, symptômes de surdosage et ce qu’il faut éviter.




